تجتاح الولايات المتحدة حاليًا أزمة صحية عامة غير مسبوقة تتمثل في تعاطي المواد الأفيونية الموصوفة طبيًا على الصعيدين الإقليمي والوطني. في حين أن الأسباب الكامنة وراء أزمة الصحة العامة هذه تخمينية إلى حد كبير ، فإن أحد العوامل المساهمة المحتملة هو التصعيد الدراماتيكي للعلاج بالأفيون الموصوف للألم المزمن خلال العقد الماضي. تدعم الدراسات قبل السريرية بشكل مقنع أن المواد الأفيونية لا تؤدي فقط إلى عواقب سلبية للألم ، ولكن أيضًا يمكن استهداف الألم المزمن من خلال الأدوية غير الأفيونية التي تفتقر إلى الإجراءات المباشرة على الخلايا العصبية وبالتالي تقليل المسؤولية عن الإدمان. إن تهريب الخلايا المناعية إلى الجهاز العصبي المركزي (CNS) والخلايا الدبقية الشبيهة بالمناعة داخل الجهاز العصبي المركزي (مثل الخلايا النجمية والخلايا الدبقية الصغيرة) ضرورية لتطوير وصيانة مشاكل الألم الحادة إلى المزمنة من خلال تنشيط جهاز المناعة العصبي غير المناسب. أحد المستقبلات المناعية الموجودة في الجهاز العصبي المركزي هو المستقبل الشبيه بالرصاص 4 (TLR4) المعروف بتحفيز إطلاق السيتوكينات المسببة للالتهابات ، مثل إنترلوكين 1 ب (IL-1b). قد توفر المركبات غير الأفيونية التي تعيق مسار TLR4-IL-1b فائدة علاجية أفضل بكثير من الأدوية الأفيونية. واحد هدف من مختبري هو تحديد العقاقير غير الأفيونية التي تستخدم الآليات المضادة للالتهابات الذاتية مما يؤدي إلى قمع السيتوكينات المسببة للالتهابات مثل IL-1b ، مما يوفر نهجًا جديدًا لعلاج الألم المزمن لدى الأشخاص بينما يفتقر إلى إمكانية حدوث آثار جانبية تسبب الإدمان. بالإضافة إلى اختبار العديد من المركبات الجديدة والمعتمدة من إدارة الغذاء والدواء ، يعمل مختبري بشكل وثيق مع مركز UNM لاكتشاف الأدوية الجزيئية http://unmcmd.health.unm.edu لتحديد واختبار علاجات الألم الجديدة المحتملة التي تتجنب الآثار الجانبية المرتبطة بالمواد الأفيونية.
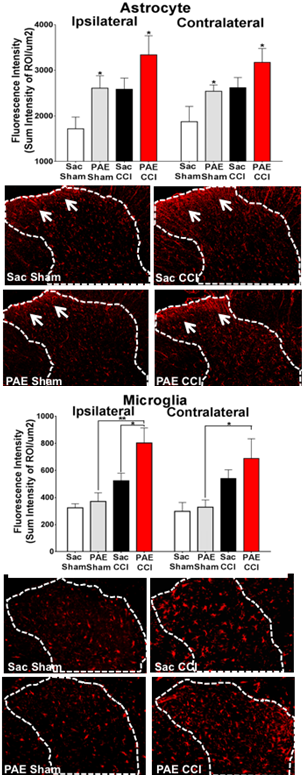
يمكن أن يؤدي التعرض للكحول أثناء الحمل إلى مجموعة من الإعاقات الخفيفة إلى الشديدة التي تشمل عيوبًا معرفية وسلوكية تمثل سلسلة متصلة يشار إليها باسم اضطرابات طيف الكحول الجنيني (FASD) ، مع انتشار حوالي 4.8٪ في بعض مناطق الولايات المتحدة. تشير مجموعة متزايدة من الأدلة بقوة إلى التأثير الضار للتعرض للكحول أثناء تطور الجهاز العصبي المركزي (CNS) على البرمجة الخلوية والجزيئية لوظيفة المناعة العصبية. في النماذج الحيوانية للتعرض للكحول قبل الولادة (PAE) ، يرتفع التعبير عن جزيئات الإشارات المناعية للدماغ ، السيتوكينات المسببة للالتهابات ، إنترلوكين -1 (IL-1β) ، عامل نخر الورم ألفا (TNF-) والكيموكين CCL2 ، بشكل ملحوظ . بينما يُعتقد أن الدليل على التشوهات الحسية بما في ذلك الحساسية اللمسية التي لوحظت لدى الأطفال المصابين بمتلازمة فرط الحركة ونقص الانتباه ناتجة عن عوامل نفسية اجتماعية ، فإن السبب الأساسي قد يشمل الخلل الوظيفي العصبي. في الواقع ، تكشف النماذج الحيوانية لـ PAE عن حساسية متزايدة للمسة الخفيفة ، وهي حالة حسية مرضية معروفة تتوسطها أفعال عصبية شاذة في النخاع الشوكي. من الناحية السريرية ، تُعرف الحساسية المفرطة للمس بالألم الخيفي في مرضى الألم المزمن ، وتُظهر النماذج الحيوانية لألم الألم التنشيط المرضي للخلايا العصبية للألم في النخاع الشوكي بوساطة IL-1β و TNF-و CCL2. تعتبر الخلايا الدبقية (الخلايا النجمية والدبقية الدبقية) من المنتجين الرئيسيين لهذه السيتوكينات المنشطة للالتهابات. وهكذا ، تكشف النماذج الحيوانية للألم الخيفي و PAE تداخلًا مفاجئًا في المناعة العصبية. الهدف من هذا البحث هو تحديد أنواع الخلايا الشوكية بخلاف الخلايا العصبية التي تلعب أدوارًا مهمة في التكيفات المناعية العصبية في ذرية PAE التي تعزز قابلية البالغين للإصابة بالاعتلال العصبي. ستوفر النتائج معرفة جديدة لفهم الأصول التطورية للتفاعلات المناعية الشاذة للجهاز العصبي المحيطي والجهاز العصبي المركزي بسبب PAE ، مما يكشف عن القابلية للإصابة بأمراض البالغين مثل آلام الأعصاب.
يعمل مختبري بشكل وثيق مع مركز أبحاث الكحول في نيو مكسيكو (NMARC ؛ مركز أبحاث الكحول في نيو مكسيكو ) لفهم الآليات العصبية الحيوية الكامنة وراء مرض الجهاز العصبي المركزي المرتبط بـ FASD ، واستخدام هذه المعرفة لتطوير تدخلات أكثر فعالية لمرضى FASD.
3. آليات مقاومة الجلوكوكورتيكويد في التعرض للكحول قبل الولادة
يتم تنظيم العديد من العمليات الفسيولوجية التي تتأثر بالتعرض للكحول قبل الولادة (PAE) بواسطة الجلوكوكورتيكويدات. ترتبط مقاومة الجلوكوكورتيكويد (أي انخفاض الحساسية لتفاعلات الخلايا الجذعية السرطانية) وعدم حساسية مستقبلات الجلوكوكورتيكويد بمجموعة متنوعة من الأمراض المزمنة ، وكثير منها يرتبط بوظيفة المناعة ويرتبط أيضًا بـ PAE. ينصب تركيز البحث على معالجة ما إذا كان PAE ينتج حساسية لمستقبلات الجلوكوكورتيكويد والتي يتم التعبير عنها على أنها خلل في تنظيم محور الغدة النخامية وزيادة في التهابات الدماغ وانخفاض في السيتوكينات المضادة للالتهابات في ظل الظروف المجهدة ، وما إذا كان هناك تحول في النمو في الإجهاد الطبيعي والمناعة يمكن ملاحظة الاستجابات خلال الحياة المبكرة ، وإذا استمرت هذه التغييرات جيدًا حتى مرحلة البلوغ. الهدف من بحث مختبري هو تحديد الآليات الجزيئية الكامنة وراء التغييرات في برمجة حساسية الجلوكوكورتيكويد أثناء تطور الجهاز العصبي المركزي والتي تستمر حتى مرحلة البلوغ. سيتم استخدام هذه المعلومات لتطوير التدخلات المستهدفة التي تعكس أو تقلل من تأثيرات PAE على حساسية مستقبلات الجلوكوكورتيكويد واستجابات جزيئات إشارات المناعة العصبية. لتحقيق هذه الأهداف ، يتعاون مختبري مع مركز أبحاث الكحول في نيو مكسيكو (NMARC ؛ مركز أبحاث الكحول في نيو مكسيكو).